CDE的2015版化学药物(原料药和制剂)稳定性研究技术指导原则发布三年多了,到现在,还有在争议,到底按照哪个标准做,听听专业人士如是说 :
附件2的指导原则“化学药物(原料药和制剂)稳定性研究技术指导原则”和《中国药典》2015年版四部9001有不少地方不一致,不知道该执行哪一个了。
举例1:
固体原料药样品应取适量放在适宜的开口容器中,分散放置,厚度不超过3mm(疏松原料药厚度可略高些);必要时加透明盖子保护(如挥发、升华等)。液体原料药应放在化学惰性的透明容器中。
vs
供试品可以用1 批原料药物进、行,将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成《5mm厚的薄层,疏松原料药物摊成《10mm厚的薄层,进行以下试验.
举例2:
长期试验的放置条件通常为25℃±2℃/60%RH±5%RH或30℃±2℃/65%RH±5%RH,
vs
长期试验采用的温度为25°C±2°C、相对湿度为60%±1 0 % ,或温度30°C±2°C 、相对湿度6 5% ± 5%。
举例3:
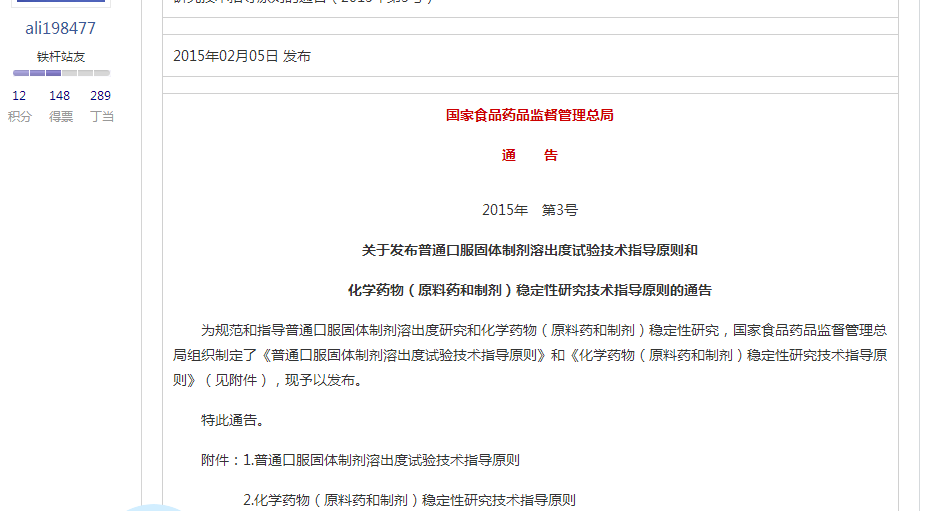
光照试验的总照度不低于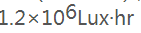 、近紫外能量不低于200w•hr/m²。
、近紫外能量不低于200w•hr/m²。
vs
(3)强光照射试验供试品开口放在装有日光灯的光照箱或其他适宜的光照装置内,于照度为4500lx士 500lx的条件下放置10天,
举例4:
加速试验通常采用3个批次的样品进行,放置在商业化生产产品相同或相似的包装容器中,试验条件为40℃±2℃/75%RH±5%RH,考察时间为6个月,检测至少包括初始和末次的3个时间点(如0、3、6月)。根据研发经验,预计加速试验结果可能会接近显著变化的限度,则应在试验设计中考虑增加检测时间点,如1.5月,或1、2月。
vs
在试验期间第1 个月、2个月、3 个月、6 个月末分别取样一次。
一个是国家局的通告,一个是药典委员会负责的药典,
不能统一一下?
还是各干各的?
附录:
日光灯
VS
LED灯
ICH&CDE:可采用任何输出相似于D65/ID65发射标准的光源,如具有可见-紫外输出的人造日光荧光灯、氙灯或金属卤化物灯。D65是认可的室外日光标准[ISO 10977(1993)],ID65相当于室内间接日光标准;应滤光除去低于320nm的发射光。也可将样品同时暴露于冷白荧光灯和近紫外灯下。冷白荧光灯应具有ISO 10977(1993)所规定的类似输出功率。近紫外荧光灯应具有320~400nm的光谱范围,并在350~370nm有大发射能量;在320~360nm及360~400nm二个谱带范围的紫外光均应占有显著的比例。
药典委:强光照射试验供试品开口放在装有日光灯的光照箱或其他适宜的光照装置内
无论是CDE指导原则,还是药典委员的指导原则,都明确写明为日光灯管,所以说对于光源的种类是有要求的,需要满足室外日光标准。本来ICH制定强光试验的出发点就是模拟太阳光的,光源不同,做出的结果自然不同。